توضیحات
عنوان: تحقیق پتانسیومتری علمی از شیمی
- پتانسیومتری
- انواع روش های اندازه گیری پتانسیل سنجی
- اسیدیته سنجی
- خطا در اندازه گیری PH
- روش انجام یک تیتراسیون پتانسیومتری
- پتانسیومتری
- پتانسیومتری pH متری
- اساس روش پتانسیوتری
- دستگاههای تیتراسیون های پتانسیومتری
- چگونگی تغییر رنگ یک شناساگر
- اهمیت استفاده از شناساگر مناسب در تیتراسیون
- تیتراسیون پتانسیومتری
- تولید PHمتر نانومقیاس
- منابع
پتانسیومتری
به معنای سنجش و اندازه گیری پتانسیل است. در شاخه ای از شیمی به نام الكتروشیمی ، بحث از پیل الكتروشیمیایی است. پیل الكتروشیمیایی دستگاهی است كه انرژی واكنش شیمیایی را كه در شرایط معمولی اغلب به صورت انرژی گرمایی آزاد می شود، به انرژی الكتریكی قابل استفاده تبدیل می نماید و مانند سدهای هیدروالكتریك، مانع از به هدر رفتن انرژی می شود. دو الكترود و یك پل نمكی ، تشكیل یك پیل را می دهند. درواقع دو الكترود به دلیل رقابت برای تبادل الكترون، تمایل متفاوت برای گرفتن الكترون دارند و این تفاوت گرفتن الكترون، در شرایط مناسب سبب انتقال الكتریسیته می شود. این جریان الكتریسیته دارای یك ولتاژ یا پتانسیل خاص می باشد كه با دستگاه ولت سنج قابل اندازه گیری است.
اول از همه باید درمورد پتانسیل سلول بدانیم. پتانسیل سلول الكتروشیمیایی به صورت اختلاف بین دو پتانسیل الكترود های كاتد و آند تعریف می شود، یعنی
پتانسیل الكترود آند – پتانسیل الكترود كاتد = پتانسیل سلول
پتانسیل الكترود به صورت پتانسیل سلولی تعریف می شود كه متشكل از الكترود مورد نظر و الكترود استاندارد هیدروژن است.
پتانسیل استاندارد الكترود یك خاصیت مهم برای توصیف سیستمهای اكسایش-كاهش است. این پتانسیل های استاندارد به دما و به غلظت یون مورد نظر از الكترود بستگی دارند.
نرنست شیمیدان آلمانی، نوعی رابطه میان ولتاژ یك سلول و شرایطی كه سلول در آن شرایط عمل می كند، كشف كرد. ولتاژ یك سلول در شرایط استاندارد به صورت E0 (كه البته صفر در بالای E قرار می گیرد) بیان می شود. این شرایط عبارتند از محلول 1 مولار مواد در دمای 25 درجه سانتیگراد و فشار 325/101 پاسكال. حال اگر ولتاژ یك سلول در شرایط غیر استاندارد E از روی ولت سنجی كه در مدار قرار گرفته است، بخوانیم، می توانیم رابطه ی زیر را برای این پیل بنویسیم:
E=E0-(RT/nF)ln (غلظت مواد واكنش دهده /غلظت محصولات )
مقدار R ثابت عمومی گازها می باشد. N تعداد الكترونهای انتقال یافته در معادله ی موازنه شده ای است كه نشان می دهد در سلول چگونه تغییری حاصل شده است. F ضریب تبدیل از ولت به ژول بر مول و مساوی 96485 است. نماد ln معرف لگاریتم طبیعی است كه می توان ان را با 2.30log جایگزین نمود. بنابراین معادله ی نرنست به صورت زیر تغییر می كند:
E=E0 – (0.05916/n)log(غلظت مواد واكنش دهنده/غلظت محصولات)
از آنجا كه در معادله ی نرنست، هم غلظت محصولات و هم غلظت واكنش دهنده ها دیده می شود، از این معادله و از طریق اندازه گكیری پتانسیل می توان به غلظت یونهای موجود در محلول پی برد. یكی از مواد استفاده ی مهم در این زمینه، ساخت pH سنج بر این اساس است. هر واكنشی كه شامل یونهای هیدروژن است، دارای پتانسیل وابسته به غلظت H+ است. این اصل در یك pH سنج به كار می رود.
انواع روش های اندازه گیری پتانسیل سنجی
1) روش مستقیم : الف.منحنی کالیبراسیون ب.افزایش محلول استاندارد
2) روش غیر مستقیم : الف.تیتراسیون های پتانسیومتری ب.تیتراسیون های دیفرانسیلی تیتراسیون های
اسیدیته سنجی
در این نوع تیتراسیون حجم معینی از محلول مجهول (اسید یا باز) را در بشرمی مریزیم – در داخل محلول الکترود ترکیبی PH را قرار می دهیم . – از بورت به محلول بشر قطره قطره محلول استاندارد را اضافه می کنیم
خطا در اندازه گیری PH
خطای قلیایی در PH زمانی رخ می دهد که ،PH قرائت شده کمتر از مقدار واقعی باشد. خطای اسیدی در PH کمتر از 5/0 رخ می دهد ،PH قرائت شده بیش از مقدار واقعی است . خطا در محلول های خنثی ، تعادل دیر برقرار می شود. نکات اولیه در PH سنجی: باید طبق دستورالعمل شرکت سازنده الکترود را نگهداری کرد.
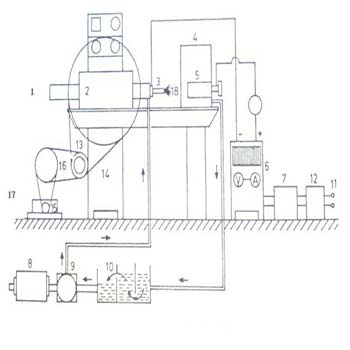
روش انجام یک تیتراسیون پتانسیومتری
وسایل تیتراسیون : دستگاه پتانسیومتر ،الکترود مرجع : کالومل اشباع یا نقره – نقره کلرید اشباع ،الکترود شناساگر : نوع الکترود شناساگر بستگی به واکنش تیتراسیون دارد ، همزن مغناطیسی و مگنت ، بورت 50 میلی لیتر ، بشر 200 میلی لیتر بلند و باریک ، پایه و گیره های لازم برای نصب الکترودها و بورت .
توجه : قبل از استفاده از هر دستگاه پتانسیومتر ، آشنایی با طرز کار آن امری ضروری است . جزئیات طرز کار هر دستگاه معمولاً در دفترچه راهنمای آن ذکر شده است . بهتر است آن را قبل از کار با دستگاه مطالعه کنید . سپس تیتراسیون را طبق مراحل زیر انجام دهید :
1) چند دقیقه قبل از شروع تیتراسیون دستگاه را روشن کنید تا گرم شود . زمان لازم برای گرم شدن دستگاه بستگی به نوع دستگاه دارد .
2) معمولاً برای تیتراسیونهای پتانسیومتری ، دستگاه پتانسیومتر و الکترودها نیاز به درجه بندی ندارند .
3) بورت را بشویید ، سپس آن را از محلول تیتر کننده پر کرده و روی صفر تنظیم کنید .
4) حجم لازم از محلول تیتر شونده را با پیست دقیق در بشر تیتراسیون بریزید و حجم آن را با آب مقطر به 150 میلی لیتر برسانید ( از درجه بندی تقریبی بشر استفاده شود . ) بهتر است برای تیتراسیون از بشرهای نوع بلند و باریک استفاده کنید .
5) مگنت را بشویید و آن را به آرامی در بشر بیندازید .
6) بشر تیتراسیون را روی همزن مغناطیسی قرار دهید و الکترودها را در آن بگذارید . انتهای الکترود دست کم 2 سانتیمتر با مگنت فاصله داشته باشد تا مگنت به هنگام چرخیدن ، با الکترود برخورد نکند.
7) بورت را روی ظرف تیتراسیون سوار کنید .
8) دستگاه پتانسیومتر را روی مد mV قرار دهید . همزن را روشن کنید و پتانسیل یا pH اولیه محلول را بخوانید و یادداشت کنید .
9) تیتراسیون را با افزایش حجمهای معینی از تیتر کننده و خواندن پتانسیل یا پی اچ ، ادمه دهید . تیتر کننده را در ابتدای تیتراسیون ، یعنی زمانی که از نقطه هم ارزی فاصله زیادی دارید ، به مقادیر زیاد بین 1 تا 2 میلی لیتر و در نزدیک نقطه هم ارزی ، یعنی از هنگامی که پتانسیل یا پی اچ رو به افزایش یا کاهش می گذارد تا زمانی که تقریباً ثابت شود ، به مقادیر بسیار کم در حدود 1/0 میلی لیتر اضافه کنید .
10) پس از عبور از نقطه هم ارزی تیتراسیون را تا افزودن چند میلی لیتر دیگر از تیتر کننده ادامه دهید . توجه : در صورتی که بتوانید تیتر کننده را در نزدیک نقطه هم ارزی به مقدار مساوی در دفعات مختلف ، به محلول اضافه کنید ، محاسبات راحتتر و منحنی بهتری بدست می آورید ، ولی این کار ضرورتی ندارد .
11) پس از پایان هر تیتراسیون الکترودها را بشویید و در آب مقطر قرار دهید و دستگاه را خاموش کنید.
توجه:
- برای دانلود فایل کامل ورد لطفا اقدام به خرید نمایید.
- پس از خرید بلافاصله لینک دانلود فایل برای شما ایمیل خواهد شد.









نقد و بررسیها
هنوز بررسیای ثبت نشده است.