توضیحات
عنوان: تحقیق اسیدهای آمینه ی آروماتیک تک حلقه ای
- اسیدهای آمینه
- ساختار اسیدهای آمینه
- انواع اسیدهای آمینه
- منو اسیدهای آمینه
- منو اسیدهای آمینه
- اسیدهای آمینه گوگرددار
- دی اسیدهای منو آمینه
- اسیدهای آمینه آمیدی
- اسیدهای آمینه دی آمین
- اسیدهای آمینه حلقوی
- اسیدهای آمینه ضروری و غیر ضروری
- اسیدهای آمینه آروماتیک تک حلقه ای
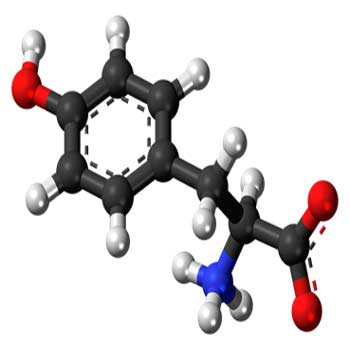
- فنیل آلانین
- نقش فنیل آلانین در بدن
- منابع غذایی فنیل آلانین
- انواع فنیل آلانین
- تیروزین
- نقش تیروزین در بدن
- منابع غذایی تیروزین
- تریپتوفان
- نقش تریپتوفان در بدن
- منابع غذایی تریپتوفان
- هیستیدین
- عوارض افزایش سطح هیستیدین
- عوارض سطح پایین هیستیدین
- نقش هیستیدین در بدن
- منابع غذایی هیستیدین
- پرولین
- منابع غذایی پرولین
- فهرست منابع و مراجع
اسیدهای آمینه
در شیمی، اسید آمینه به هر مولکولی اطلاق می شود که دارای گروههای کاربردی آمینه و اسید کربوکسیلیک باشد. اسید آمینه واحد تشکیل دهنده پروتئین است. در بیوشیمی به اسیدهای آلفا آمینو یعنی آن اسید آمینه هایی که در آنها کارکردهای آمینو و کربوکسیلات هر دو به کربنی یگانه چسبیدهاند، اسید آمینه گفته می شود. آمینو اسید ها در حالت طبیعی به صورت یون دو قطبی بوده و شبیه نمک ها در آب محلول و در حلال های آلی مانند اتانول و دی اتیل اتر نامحلول هستند.
فرمول کلی تمامی اسیدهای آمینه موجـود در طبیعـت بـدین گونـه است :
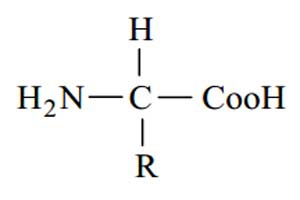
تمامی اسیدهای آمینه در pH شدیداً اسیدی دارای بار مثبت می باشند و علت آن پروتونه شدن گـروه هـای (Coo )
و (NH) است. در pHشدیداً اسیدی ساختار اسیدهای آمینه به شکل زیر است :
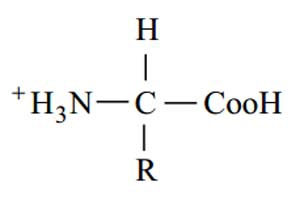
در pH های شدیداً بازی به علت جدا شدن پروتون ها (H) از گروه های(NH+ ) و (COOH)، بار کلی اسید آمینـه منفی است و ساختار آن به شکل زیر می باشد :
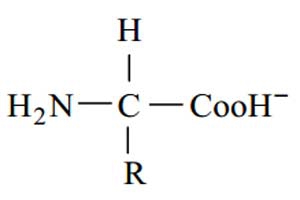
اسیدهای آمینه با توجه به خصوصیات زنجیره ی Rبه چند دسته تقسیم می شوند. ایـن زنجیـره، یـا دارای گـروه هـای هیدروفوب مانند(CH ) است یا دارای گروه های اسیدی و بازی ماننـد (NH+ و Coo) و یـا حـاوی گـروه هـای
قطبی مانند ( OH) است.
ساختار اسیدهای آمینه
هر اسید آمینه، از یک کربن نامتقارن به نام کربن آلفا (α) تشکیل یافتهاست که با چهار گروه مختلف کربوکسیل (COOH) اتم هیدروژن، گروه آمینه بازی (NH) و یک زنجیره غیر جانبی (R) پیوند برقرار میکند. ریشه R ممکن است یک زنجیره کربنی و یا یک حلقه کربنی باشد. عوامل دیگری مانند الکل، آمین، کربوکسیل و نیز گوگرد میتوانند در ساختمان ریشه R شرکت کنند. زنجیره جانبی، خود چندین اتم کربن دارد و آنها را به ترتیبی که از کربن آلفا، فاصله میگیرند، با حروف بتا (β)، گاما (γ) و دلتا (δ) نشان میدهند. اگر در حالی که عامل COOH روی کربن آلفا قرار داد عامل NH روی کربنهای غیر آلفا قرار گیرد، نوع اسید آمینه به β، γ یا δ تغییر خواهد کرد. اسیدهای آمینه آزاد به مقدار بسیار ناچیز در سلولها وجود دارند. بیشتر اسیدهای آمینه آلفا در سنتز پروتئین شرکت میکنند، در صورتی که اسیدهای آمینه بتا، گاما و دلتا واسطه های شیمیایی هستند. بیشتر اسیدهای آمینه در pH هفت به صورت دو قطبی در میآیند. یعنی گروه NH پروتون میگیرد و گروه COOH هیدروژن خود را از دست میدهد و به صورت COO در میآید. زنجیره جانبی (گروه) R برای پروتئینها میتواند یکی از ۲۰ حالت مختلف ممکن باشد و بدین ترتیب یک الفبای 0 حرفی برای ساخت پروتئینها بوجود میآید. این 0 اسید آمینه میتوانند با هر ترکیب و به هر تعداد در ساختار یک پروتئین دخالت کنند. ساختار و طبقه بندی این 0 اسید آمینه در شکل زیر نمایش داده شده است.
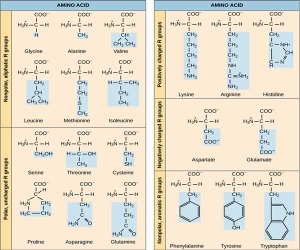
انواع اسیدهای آمینه
اسیدهای آمینه به انواع زیر تقسیم بندی می شوند.
منو اسیدهای آمینه
گلیکوکول (Gly):: گلیکوکول که گلیسین نیز نامیده میشود، تنها اسید آمینهای است که فاقد کربن ناقرینه است و در ساختمان پروتئین هایی مانند کلاژن ، الاستین و رشته ابریشم به مقدار فراوان وجود دارد.
آلانین (Ala): در تمام پروتئین ها فراوان است.
والین (Val): اسید آمینه ضروری برای انسان است و به مقدار کم در بیشتر پروتئین ها یافت میشود.
لوسین (Leu): اسید آمینه ضروری برای انسان بوده و در بیشتر پروتئین ها به مقدار زیاد وجود دارد.
ایزولوسین (Ile): اسید آمینه ضروری برای انسان است که به مقدار کمتر از اسیدهای آمینه دیگر پروتئین ها وجود دارد. ایزولوسین دو کربن ناقرینه دارد.
توجه:
- برای دانلود فایل کامل ورد لطفا اقدام به خرید نمایید.
- پس از خرید بلافاصله لینک دانلود فایل برای شما ایمیل خواهد شد.

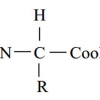
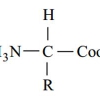
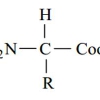









نقد و بررسیها
هنوز بررسیای ثبت نشده است.